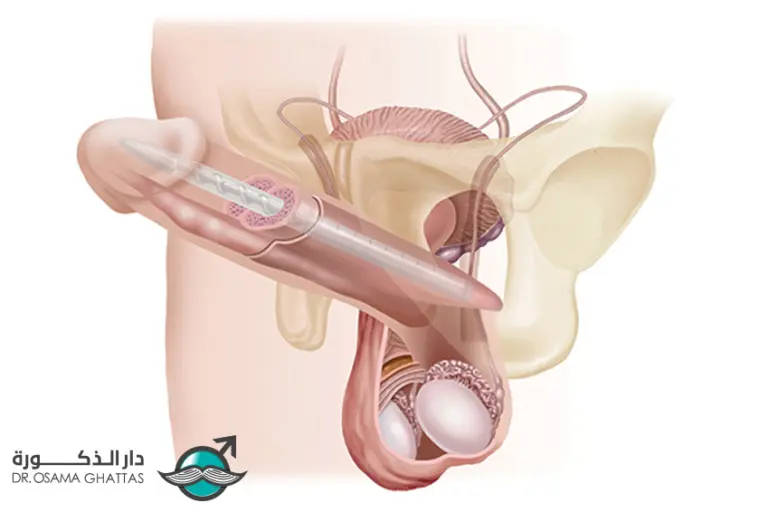
قياس التأكسج النبضي على القضيب أثناء جراحة زراعة دعامة القضيب
المفهوم والأساس العلمي:
يقيس جهاز قياس التأكسج النبضي:
- تشبع األوكسجين (SpO(₂في الدم بشكل لحظي.
- التدفق النبضي، مما يساهم في تأكيد التروية الدموية.
- في جراحة زراعة دعامة القضيب ، يعتمد القضيب (خاصة األجسام الكهفية والحشفة)
على إمداد دموي جيد للحفاظ على صالحية
الأنسجة. استخدام جهاز قياس التأكسج النبضي على القضيب قد يكون ذا فائدة نظرية لمراقبة التروية الدموية أثناء الجراحة وضمان
(عدم وجود أي تضرر وعائي (مثل التمدد المفرط، الورم الدموي، أو إصابة األوعية الدموية.
هل يتم ذلك؟
لا توجد ممارسة معيارية:
ال توجد أدلة أو إرشادات حاليا تشير إلى استخدام جهاز قياس التأكسج النبضي على القضيب بشكل روتيني أثناء جراحة زراعة
الدعامة .
أمثلة مشابهة:
تم استكشاف مراقبة تروية األنسجة في جراحة إعادة بناء القضيب مثل (الفالوبالستي) باستخدام تقنيات مثل:
- الطيفية القريبة تحت الحمراء.(NIRS)
- قياس التدفق بالليزر دوبلر.
في جراحة زرع دعامة القضيب ، تركز المخاوف الرئيسية على:
- تجنب إصابة اإلحليل، الحزمة العصبية الوعائية الظهرية، واألجسام الكهفية.
- منع العدوى والتآكل بعد الجراحة .
- ضمان وضع األسطوانة بشكل صحيح.
لا يُعتبر مراقبة التروية الدموية في الوقت الفعلي أمرا بالغ الأهمية لأن:
توجد الأجسام الكهفية داخل القضيب، وهي غنية بالأوعية الدموية.
عادة ما تكون إصابة الأوعية الدموية واضحة من خالل النزيف أو تغير اللون.
معلومات تشريحية:
من الناحية التشريحية، يُزَّود القضيب بالدم بشكل غني من ثالثة شرايين رئيسية: الشريان الظهري القضيبي، والشريان البصلي
الأحليلي، والشريان الكهفي. الشريان الذي يُغذي حشفة القضيب هو الشريان البصلي الأحليلي، بينما الشريان الكهفي هو الشريان
الذي يُغذي الجسمين الكهفيين.
لا يوجد اتصال بين الشريانين. هذا يعني أنه حتى في حال تلف الشريان الكهفي بالكامل أثناء الجراحة، وهو أمر مستبعد، فإن ذلك
لن يؤثر على الشريان الذي يُغذي حشفة القضيب، ولن يؤثر على تدفق الدم إلى حشفة القضيب أو محتواه من الأكسجين. بالأضافة
إلى ذلك، فإن موقع الشق الجراحي، الذي يقع عادة في الجانب البطني من القضيب أو في الزاوية بين القضيب وكيس الصفن، بعيد
كل البعد عن الضفيرة العصبية والأوعية الدموية للقضيب، والتي تُسمى الحزمة العصبية الوعائية، والتي تقع على ظهر القضيب.
وهذا يعني أنه من غير المحتمل تما ما أن تتضرر الأوعية الدموية الرئيسية والأعصاب الرئيسية للقضيب أثناء هذا النوع من
الجراحة، على عكس جراحات القضيب الأخرى مثل تصحيح االنحناء، أو جراحات إعادة بناء القضيب .
العيوب والتحديات المحتملة:
تصميم المستشعر:
أجهزة قياس التأكسج النبضي المصممة للأصابع أو أصابع القدم ليست مصممة لتناسب تشريح القضيب، خاصة في اأنسجة
المرتخية أو التي تم التلاعب بها جراحيا. قد يكون تعديل المستشعر (مثل استخدام مشبك الأذن أو لفائف مرنة) أمرا صعب.
تشويش الحركة:
التالعب الجراحي بالقضيب يسبب حركة كبيرة وتغيرات في الضغط والشد، مما قد يؤدي إلى قراءات غير دقيقة أو غير مستقرة
قيمة مضافة محدودة:
تضرر التروية الدموية أثناء هذه الجراحة نادر وعادة ما يكون مرئيا سريريا.
المضاعفات الرئيسية بعد الجراحة (مثل العدوى أو التآكل) ليست مرتبطة مباشرة بالتروية الدموية أثناء العملية في معظم الحاالت.
التكلفة والتعقيد:
إضافة خطوات ومعدات إضافية إلى إجراء جراحي بسيط قد يزيد من التعقيد والتكلفة.
الخلاصة:
لا توجد حاليا قاعدة أدلة أو ممارسة معيارية الستخدام جهاز قياس التأكسج النبضي أثناء جراحة زرع دعامة القضيب .
خاصة للبحث، لكنها تواجه تحديات عملية (مثل ملاءمة المستشعر، التشويش، والقيمة الفكرة مثيرة للأهتمام من الناحية النظرية،
السريرية غير الواضحة).
المراقبة الأكثر تقد مامثل NIRS أو قياس التدفق بالليزر دوبلر (قد استخدمت بشكل محدود في إعادة بناء القضيب المعقدة، لكنها لم
تُستخدم في زراعة الدعامات.
المراجع
- Nitzan, Meir, Amir Romem, and Robert Koppel. “Pulse Oximetry: Fundamentals and .1
Technology Update.” Medical Devices (Auckland, N.Z.) 7 (2014): 231–39.
https://doi.org/10.2147/MDER.S47319 - McMorrow, Robert C., and Monty G. Mythen. “Pulse Oximetry.” Current Opinion in .2
Critical Care 12, no. 3 (2006): 269–71.
https://doi.org/10.1097/01.ccx.0000224873.16700.78. - Petersen, Christine L., Tzu-Pin Chen, Joseph M. Ansermino, and Guy A. Dumont. “Design .3
and Evaluation of a Low-Cost Smartphone Pulse Oximeter.” Sensors (Basel) 13, no. 12
(2013): 16882–93. https://doi.org/10.3390/s131216882. - Jose, Binu, Rakesh Lodha, and Sushil K. Kabra. “Comparison of Two New Generation .4
Pulse Oximeters with Arterial Oxygen Saturation in Critically Ill Children.” Indian Journal
of Pediatrics 81, no. 12 (2014): 1297–1301. https://doi.org/10.1007/s12098-014-1381-z. - Seifi, Shahram, Ali Khatony, Gholamreza Moradi, Ahmad Abdi, and Fariba Najafi. .5
“Accuracy of Pulse Oximetry in Detection of Oxygen Saturation in Patients Admitted to
the Intensive Care Unit of Heart Surgery: Comparison of Finger, Toe, Forehead and
Earlobe Probes.” BMC Nursing 17, no. 15 (2018). https://doi.org/10.1186/s12912-018-
0283-1. - Clayton, D. G., R. K. Webb, A. C. Ralston, D. Duthie, and W. B. Runciman. “Pulse .6
Oximeter Probes: A Comparison Between Finger, Nose, Ear, and Forehead Probes under
Conditions of Poor Perfusion.” Anaesthesia 46, no. 4 (1991): 260–65.
https://doi.org/10.1111/j.1365-2044.1991.tb11492.x. - Morey, Timothy E., Michael J. Rice, Thomas Vasilopoulos, David M. Dennis, and Richard J. .7
Melker. “Feasibility and Accuracy of Nasal Alar Pulse Oximetry.” British Journal of
Anaesthesia 112, no. 6 (2014): 1109–14. https://doi.org/10.1093/bja/aeu095. - Robertson, R. E., and R. F. Kaplan. “Another Site for the Pulse Oximeter Probe.” .8
Anesthesiology 74, no. 1 (1991): 198. https://doi.org/10.1097/00000542-199101000-